重大进展!研究发现IL-24有望成为通用癌症杀手
- 发布时间:2021-05-10
- |
- 作者: towersimper 生物谷 2021-05-10
- |
- 阅读次数:51次
在之前的研究中,科学家们已发现一种称为IL-24(白细胞介素-24)的蛋白以多种不同的方式攻击各种癌症。在一项新的研究中,通过T细胞工程,来自美国弗吉尼亚联邦大学的研究人员发现利用T细胞将编码IL-24的基因(称为MDA-7)递送到实体瘤中,可以阻止多种癌症的肿瘤生长,并抑制癌症向其他组织的扩散。
相关研究结果发表在2021年5月的Cancer Research期刊上,论文标题为“Engineering T Cells to Express Tumoricidal MDA-7/IL24 Enhances Cancer Immunotherapy”。
研究人员表示,他们参与的研究工作扩大了免疫疗法的范围,他们的方法不太依赖于癌细胞表达的特定靶标。毕竟,这不是第一次将T细胞设计用于癌症免疫治疗。
美国食品药品管理局(FDA)批准的旨在摧毁表达特定表面分子的癌细胞的嵌合抗原受体(CAR)T细胞(CAR-T)疗法在治疗血液和淋巴系统的晚期癌症方面已显示出巨大的成功。但是,CAR-T细胞在治疗前列腺癌或黑色素瘤等实体瘤方面取得的进展有限,因为构成这些肿瘤的细胞并不完全相同,这阻碍了工程化T细胞对肿瘤细胞的识别和攻击。
研究人员用MDA-7/IL-24武装T细胞,以更广泛地靶向癌症。他们对T细胞进行基因改造使之表达MDA-7/IL-24,从而允许这些T细胞杀死癌细胞,不论后者是否表达靶分子。这将有助于阻止癌细胞逃避免疫攻击。
在亚细胞水平下,MDA-7/IL-24与细胞表面上的受体结合,并指示它们制造和释放更多的MDA-7/IL-24蛋白。如果细胞是正常的,该蛋白只是被分泌出来,不会发生损害。但如果细胞是癌细胞,MDA-7/IL-24会导致氧化应激损伤,并最终导致细胞死亡,这不仅发生在原发性肿瘤内,而且发生在远处的转移灶中--90%的患者死亡的原因。
作为这一过程的结果,免疫系统产生了理论上可以在肿瘤复发时杀死它的记忆T细胞。在整个肿瘤层面,IL-24也阻止了血管的形成,使肿瘤失去了维持其无节制生长所急需的营养物。在患有前列腺癌、黑色素瘤或其他转移性癌症的小鼠中,表达MDA-7/IL-24的T细胞(即MDA-7/IL-24 T细胞)比未修饰的T细胞更能减缓或阻止癌症进展。
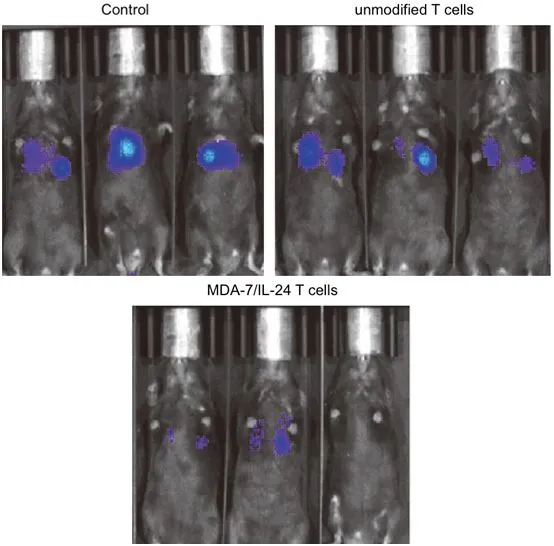
患有前列腺癌的对照组小鼠(上左侧)显示肺部有大面积的转移病灶(蓝色)。当一部分小鼠接受未修饰的T细胞治疗时(上右侧),它们体内的继发性肿瘤比未接受治疗的小鼠要小。当另一组小鼠接受经基因改造后表达MDA-7/IL-24的T细胞时(下侧),转移病灶缩小得更多,在某些情况下甚至缩小到没有。
图片来自Cancer Research, 2021, doi:10.1158/0008-5472.CAN-20-2604。
研究还发现,用MDA-7/IL-24武装T细胞,使它们能够更好地生存,并在肿瘤微环境中增殖。肿瘤微环境通常对免疫细胞非常不利。他们发现MDA-7/IL-24可以帮助T细胞增殖并超过癌细胞的数量。
在临床上,这种方法将涉及从肿瘤样本中提取患者自身的T细胞,对它们进行基因改造使之表达MDA-7/IL-24,在实验室中进行培养以便产生数百万个细胞,最后将它们移植回患者体内。在美国联邦政府授权的制造标准下,该方法通常是安全的和微创的。CAR-T细胞也可能经基因改造后表达MDA-7/IL-24。
为了达到最佳效果,MDA-7/IL-24 T细胞可能会与其他疗法一起使用。尽管将这项技术从实验室带到床边绝非易事,但是这些作者乐观地认为大部分基础工作已经奠定。
使用不同方法递送IL-24用于治疗几种癌症的临床试验已经在进行中。一项利用腺病毒向肿瘤递送MDA-7/IL24的1期临床试验显示,对多种形式的癌症有大约44%的疗效,而且一般无毒。
这些作者最近共同获得了美国国家癌症研究所的资助,以优化他们的技术,用于治疗实体瘤和癌症转移,以期待未来的人体临床试验。
参考资料:
Zheng Liu et al. Engineering T cells to express tumoricidal MDA-7/IL-24 enhances cancer immunotherapy. Cancer Research, 2021, doi:10.1158/0008-5472.CAN-20-2604.
生物谷 生物谷致力于为生命科学领域科研人群、生物医药产业界人士分享非常新鲜的生命科学研究资讯、非常齐全的生物医药产业动态。在这里,趣味科普与行业干货齐飞,学术大咖与吃瓜群众同乐。还有更多精彩活动等着你! 公众号
地址:广州市金穗路9号 邮编:510623 电话:020-81886332 粤ICP备14021518号 访问量: 304664