子宫腺肌病从发病机制到药物选择的新进展(第二部分)
- 发布时间:2019-08-12
- |
- 作者:程傲霜 邓姗 妇产科空间 20190-08-12
- |
- 阅读次数:90次


AM病灶中可观察到上皮细胞E⁃钙黏蛋白表达丢失、间充质细胞N⁃钙黏蛋白和波形蛋白的表达增加,提示上皮⁃间质转化(EMT)是AM进展的关键环节[13⁃14],而EMT存在雌激素依赖性[14]。研究显示,雌激素可显著上调膜联蛋白A2的表达[15],通过缺氧诱导因子1α/血管内皮生长因子A(VEGF⁃A)途径增强子宫内膜细胞的促血管生成能力,并可促进EMT。使用雷洛昔芬(选择性ER调节剂,能阻断雌激素诱导的信号传导)治疗后,间充质表型恢复,提示雷洛昔芬可能是通过抑制EMT而阻断AM进展[14⁃15]。EMT抑制剂治疗AM尚处于初步探索阶段。血小板聚集和激活也参与 EMT的病理机制。转化生长因子β1/转录调节因子Smad3信号传导途径被证实与诱导EMT相关[16]。而小鼠模型的研究表明,抗血小板制剂存在治疗AM的潜能[17]。EMT可能涉及早期疾病进展,而细胞集体迁徙是后期 AM病变侵袭过程中的重要现象[18⁃19]。另外,血管生成也是AM发生发展的重要因素之一[20]。由此推断,抗血管生成因子制剂也可能具有治疗AM的潜能。
基因的多态性及变异、RNA调控、表观遗传失调、DNA甲基化水平变化均与AM的易感性及发生发展相关[6,21⁃23]。 AM患者的在位和异位内膜中,Ⅰ类组蛋白去乙酰化酶(HDAC)的表达显著增加,且与痛经的严重程度相关[24]。而性激素及其受体水平被证实与HDAC的表达存在关联性。HDAC抑制剂可抑制细胞增殖,使异位的基质细胞发生凋亡[25]。故而,丙戊酸(为HDAC抑制剂)被用于治疗难治性AM,可缓解痛经和减小子宫体积[26],可能是通过干预AM的异常高甲基化而发挥疗效[27]。 综合前述观点,可以认为,大部分AM患者存在子宫内膜⁃肌层交界区异常和子宫收缩异常,在环境修饰等表观遗传因素的作用下,导致AM的发生。子宫内膜⁃肌层交界区异常和子宫收缩异常的深层原因是子宫内膜异常,包括干细胞、免疫和激素反应异常等。因此,AM发病机制的“子宫内膜基底内陷理论”及“干细胞异位分化理论”与子宫内膜异位症的“在位内膜决定论”也十分契合。
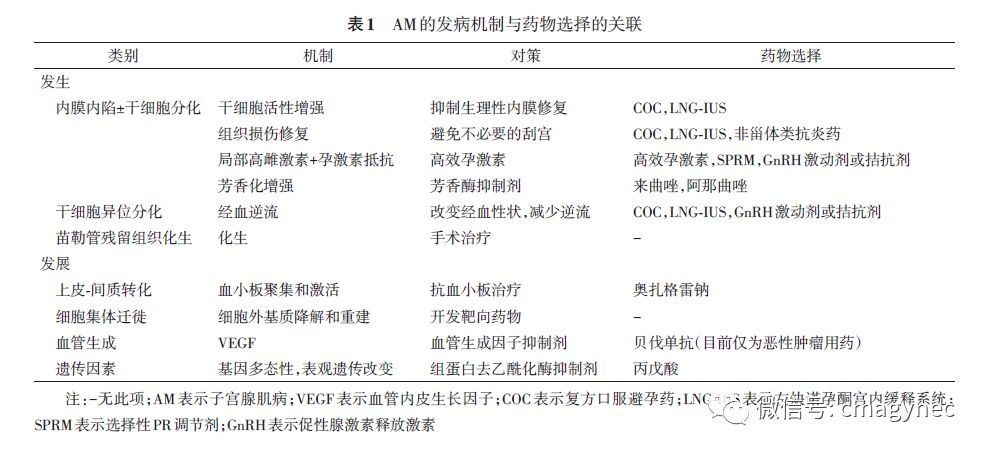
目前尚无大型或随机对照研究对AM的药物疗效进行系统评估,药物研发的进展缓慢[28]。对于有生育需求的AM患者,迫切需要探索缓解症状、保护生育力的保守治疗方案。目前的常用药物方案对于改善盆腔疼痛、异常子宫出血和不孕的疗效有限。药物治疗以甾体激素类药物为主,包括高效孕激素(如醋酸炔诺酮、地诺孕素、LNG⁃IUS)、短效复方口服避孕药以及GnRH类似物(激动剂和拮抗剂)。结合上述AM的发病机制,各自的药用机制简要列举于表1。同时也有一些新药,如选择性PR调节剂(SPRM)、芳香酶抑制剂、丙戊酸和抗血小板制剂等正在开发,略述如下。 1. 芳香酶抑制剂:Kimura等[29]首次报道使用芳香酶抑制剂治疗1 例希望保留生育功能的严重AM妇女,口服阿那曲唑1~2 mg/d联合GnRH激动剂共用16周,治疗8周后子宫体积缩小60%,患者在停止芳香酶抑制剂给药后6个月未再发生异常子宫出血。1项随机对照试验显示,芳香酶抑制剂与GnRH激动剂在减小子宫腺肌瘤体积和改善症状方面具有相同的效果[30]。 2. SPRM:SPRM已成为激素依赖性疾病的有效的治疗选择,SPRM在子宫内膜中表现孕激素激动剂和拮抗剂活性,可减轻疼痛、出血,抑制细胞增殖和炎症,因此对治疗子宫内膜异位症和AM可能有效。有关米非司酮的证据表明,其可影响AM组织中半胱氨酸天冬氨酸蛋白酶3(caspase⁃3)的表达,诱导细胞凋亡,抑制AM的发生和发展[31]。然而,目前针对AM的临床研究数量少。每日口服米非司酮50 mg共6个月,可改善疼痛并可使子宫内膜异位症病变消退[32]。1项回顾性研究提示,醋酸乌利司他(5 mg/d,用药12周)能显著缓解AM的临床症状,促进闭经[33]。目前1项Ⅱ期随机双盲对照试验正在进行,其将醋酸乌利司他(10 mg,每天1次,用药3个月)用于希望保持生育力的AM患者[34]。 3. GnRH 拮抗剂:GnRH 拮抗剂(GnRH⁃ant)是与天然GnRH结构相似的肽化合物,其通过对垂体中的GnRH受体的直接拮抗作用来抑制生殖内分泌系统,阻断促性腺激素的分泌。其作用机制不同于GnRH激动剂,不会诱导GnRH受体的下调或脱敏,而是竞争性地阻止内源性GnRH与垂体中的受体结合。因此,根据剂量可以调节雌二醇的抑制强度,可以不必反向添加[35]。最近两项Ⅲ期临床试验,采用不同剂量的Elagolix(1种口服非肽GnRH⁃ant)治疗子宫内膜异位症,用药6个月能有效改善痛经和非经前期盆腔疼痛[36]。由此推测,GnRH⁃ant也可用于AM相关症状的治疗。 4. 丙戊酸:丙戊酸是1种特异和有效的HDAC抑制剂,有研究证明,其可有效治疗超声或MRI诊断的中度至重度AM,可减少痛经和子宫出血并缩小子宫体积[26],但因其为非常规治疗方法,目前报道的病例数较少。AM小鼠模型的研究表明,丙戊酸可抑制AM的肌层浸润,改善全身性痛觉过敏,减少子宫收缩的振幅和不规则性[37]。 5. 抗血小板治疗:新的证据支持血小板在AM发病机制中的重要作用,血小板可诱导EMT、成纤维细胞向肌纤维细胞的转化,最终导致纤维化[18]。在AM小鼠模型中的研究发现,予奥扎格雷钠和血小板耗竭抗体进行干预均能抑制子宫肌层浸润,改善全身性痛觉过敏,减少子宫的过度活动,改善已知参与AM的一些蛋白质的表达,并减缓纤维化[17]。这些均支持,抗血小板治疗对AM的治疗有潜在价值。
由AM的发病机制来看,目前药物的疗效有限,可能与药物干预的时间过晚或不能对抗多种机制有关;复方口服避孕药及LNG⁃IUS对于预防AM发生、早期病变进展的潜在价值可能远大于其治疗显著病变的功效。通过对AM发病机制的进一步了解,结合细化的影像学分型,在寻找新型药物治疗AM、保留和改善生育结局的同时,更深切的需求可能在于筛选AM的遗传易感人群或通过分子标志物和高分辨影像学技术提高早期诊断、早期干预的能力,进而个体化指导和落实预防用药理念,减少显著性和难治性AM的发生。
地址:广州市金穗路9号 邮编:510623 电话:020-81886332 粤ICP备14021518号 访问量: 304239